地球的元素
结构
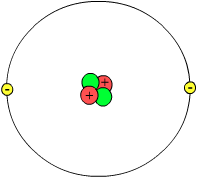 在这个氦原子的模型中,中心是原子核。(图并非按比例绘制)
在这个氦原子的模型中,中心是原子核。(图并非按比例绘制)
质子、中子和电子构成了原子。因此,它们被称为亚原子粒子。每种类型的原子在质子、中子和电子的数量上可以有所不同。根据当前的原子电子云理论,原子有两个部分:原子核和电子云。原子核由质子和中子组成,而这些核子本身又由三组更小的粒子——称为“夸克”——构成。
原子核是原子的中心,包含质子和中子。与电子云的大小相比,原子核非常小。这意味着原子核周围有大量的空隙。原子的质子和中子位于特定的位置。质子和中子的质量大约是1个原子质量单位(amu)。因此,原子的原子质量是质子和中子数量的总和。(电子的质量轻千倍,因此不计入计算。)
质子带有正电荷。质子的数量决定了原子的元素。例如,如果原子有一个质子,那它就是氢原子;只有氢元素才能有一个质子。在元素周期表中,元素的原子序数与其质子数量相同。
中子不带电,但它们帮助稳定原子核;如果只有质子的正电荷存在于原子核中,它们会相互排斥,使原子核不稳定。同一元素的不同中子数量的原子叫做同位素。例如,氢有三种自然同位素,一种没有中子,一种有一个中子,还有一种有两个中子。它们都有一个质子,因此都是氢元素,但由于中子数量不同,它们是不同的同位素。有些同位素是放射性的,意味着它们会衰变或随着时间释放能量。例如,碳-14(原子质量为14的碳)是一种放射性同位素,考古学家通过它来测定化石的年龄。因为他们知道碳-14衰变的速度。
原子外部的部分,即电子云,环绕在原子核周围。根据量子力学理论,我们无法知道某个特定电子的确切位置或速度;我们只能说它在某个位置的概率。如果我们知道电子的确切位置,就无法知道它的速度。如果我们知道它的速度,同样我们也无法确定它的具体位置。电子带有负电荷,其电荷强度与质子的正电荷相等。一些科学家曾认为电子像行星围绕太阳那样绕原子核运行,但现在我们知道这并不准确。电子在原子核周围有些是随机运动的,并且会被原子核内质子的正电荷吸引。
原子 = 构建块
原子是化学和宇宙万物的基础。你应该记住,物质是由原子组成的。原子和原子的研究构成了一个独立的世界。我们将介绍一些基本知识,如原子结构和原子间的键合。当你学得更多时,你可以进一步学习生物化学教程,了解原子如何形成有助于生物世界生存的化合物。
电子排列
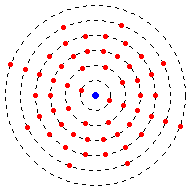 这个玻尔模型展示了一个钡原子,它有六个能级。最靠近原子核的能级是第一个能级。
这个玻尔模型展示了一个钡原子,它有六个能级。最靠近原子核的能级是第一个能级。
电子在能级中排列。
| 能级 | 电子容量[1] |
|---|---|
| 第一个能级 | 2 |
| 第二个能级 | 8 |
| 第三个能级 | 18 |
| 第四个能级 | 32 |
| 第五个能级 | 50 |
| 第六个能级 | 72 |
能级并不需要填满才能让电子处于更高的能级。例如,钛的电子排布是2-8-10-2。这意味着它在第一个能级有2个电子,在第二个能级有8个电子,在第三个能级有10个电子,在第四个能级有2个电子。
如前所述,有些原子只有特定数量的电子,因此某些元素的电子能级比其他元素少。
最外层的能级称为价能级。同样,最外层能级中的电子称为价电子。这些电子帮助原子结合成分子。
参考
每个能级的电子容量是多少?